Витамин участвующий в реакции карбоксилирования
Биологическая роль этого процесса заключается в активации группы Hj ацетил-КоА путем превращения в более реакционную метиленовую ( Hj) малонил-КоА. Эта реакция катализируется ферментной системой — аце-тил-КоА-карбоксилазой, коферментом которой является биотин (витамин И), активатором — ионы марганца (Мп ). Суммарную реакцию карбоксилирования ацетил-КоА можно записать следующим образом [c.341]
Химизм реакции обходного пути фосфорилирования пирувата приведен в табл. 20.1. Первая необратимая реакция глюконеогенеза катализируется мита-хондриальной пируваткарбоксилазой, которая содержит в качестве кофермента витамин Н (биотин). В митохондриях этот фермент катализирует АТФ-зави-симую реакцию карбоксилирования пирувата, в ходе которой образуется оксалоацетат. Для оксалоацетата внутренняя мембрана митохондрий непроницаема, и транспорт его в цитоплазму происходит с помощью малатного челночного механизма. Митохондриальная малатдегидрогеназа восстанавливает оксалоацетат до малата, который может выходить в цитоплазму. Затем уже цитоплазматическая малатдегидрогеназа окисляет малат до оксалоацетата для последующего участия в реакции, катализируемой фосфоеноилпируваткарбоксики- [c.273]
В некотором смысле это превращение моделирует карбоксилирование биотина по азоту и последующий перенос карбоксильной группы к атому углерода, связанному с карбонильной группой. [c.482]
БИОТИН (витамин И), мол. м. 244,3 один из витаминов группы В кофермент, участвующий в карбоксилировании орг. к-т. С ферментами связан пептидной связью, образованной его карбоксильной группой и е-аминогруппой остатка лизина в молекуле апофермента. Из 8 оптич. изомеров и 4 рацематов биол. активностью обладает только (-1-)-Б. (см. ф-лу). [c.290]
Ферменты, катализирующие реакции карбоксилирования, содержат в качестве кофактора биотин (80), который связан своей карбоксильной группой с г-аминогруппой остатка лизина апофермента [c.151]
Ниже приведены еще несколько простейших коферментов и кофакторов. Кофактором ферментов в ряде обратимых реакций карбоксилирования является биотин [c.567]
Биотин служит коферментом в двух типах ферментативных реакций. Первый тип может быть представлен АТФ-зависимым карбоксилированием, сопряженным с превращением АТФ в АДФ и неорганический фосфат, например [c.234]
Биотин был впервые выделен и идентифицирован как фактор роста дрожжей в 1935 г. Вопреки наблюдавшемуся в 40-х гг. быстрому прогрессу в области изучения водорастворимых витаминов функция биотина оставалась тайной до 1959 г., когда Линем и сотр. заметили, что бактериальная р-метилкротонил-СоА-кар-боксилаза осуществляет карбоксилирование свободного (+)-б.ио-тина в отсутствие своего природного субстрата СоА-тиоэфира. [c.469]
Поскольку биотин участвует в реакциях карбоксилирования, по-видимому, как нуклеофильный катализатор, Каплоу и Ягер [331] использовали в качестве аналога биотина имидазолидон-2. Исследования декарбоксилирования Ы-карбокси-2-имидазолидона [c.475]
Однако, поскольку неизвестна степень участия фермента в стабилизации уходящей группы аниона X в биотинзависимых реакциях карбоксилирования, нельзя сказать заранее, что произойдет О- или N-атака. Ясно, что простые модельные соединения не всегда надежные индикаторы активности моделируемых групп в составе фермента [343]. Возможно, связанный с ферментом биотин реагирует в форме высокоэнергетической изомочевины, поскольку при этом нуклеофильность атома азота повыщена. [c.477]
Образование малонил-КоА. Первой реакцией биосинтеза жирных кислот является карбоксилирование ацетил-КоА, для чего требуются бикарбонат, АТФ, ионы марганца. Катализирует эту реакцию фермент ацетил-КоА-кар-боксилаза. Фермент содержит в качестве простетической группы биотин. Авидин—ингибитор биотина угнетает эту реакцию, как и синтез жирных кислот в целом. [c.383]
Происходящие в процессе реакции превращения означают, что карбонильная группа биотина служит акцептором протонов в одном случае и донором протонов в другом. Более вероятный механизм предполагает наличие внещнего основания. Таким образом, альтернативой согласованному механизму служит ступенчатый процесс, включающий отщепление а-протона с последующим карбоксилированием. Чтобы показать возможность такого механизма, было исследовано [346] действие пропионил-СоА-карбо- [c.484]
Биотин служит переносчиком карбоксильных групп в ряде реакций Р-карбоксилирования типа 5.В (табл. 7-1). Первым указанием на существование этой функции явились данные о способности аспартата частично заменять биотин в стимулировании роста дрожжей Тоги1а сгетог1з. Было известно, что аспартат образуется путем переаминирования из щавелевоуксусной кислоты, которая в свою очередь могла образоваться путем р-карбоксилирования пирувата. Последующие исследования показали, что биотин необходим в АТР-зависимой реакции между пируватом и бикарбонат-ионом [c.194]
Метилмалонильный путь (рис. 9-6) начинается с биотин- и АТР-зависимого карбоксилирования пропионата. Образующийся при этом (5)-метилмалонил-СоА изомеризуется в (7 )-метилмалонил-СоА (читатель мог бы указать простой механизм этой реакции), после чего ме-тилмалонил-СоА превращается в сукцинил-СоА — на этой стадии роль кофермента играет витамин B12 (табл. 8-6). Сукцинил-СоА превращается в свободный сукцинат (образующийся при этом GTP компенсирует затраченный вначале АТР). Сукцинат путем р-окисления превращается в оксалоацетат, который декарбоксилируется в пируват (фактически удаляется двуокись углерода, присоединившаяся на начальной стадии). Пируват путем окислительного декарбоксилирования превращается в ацетил-СоА. Можно задать естественный вопрос зачем природе понадобилось столь усложнять путь, который мог бы быть намного более прямым Ответить на этот вопрос трудно, однако некоторые соображения по этому поводу все же имеются. [c.334]
Установлена природа соединения, образующегося из диоксида углерода и связанного с ферментом биотина (106) [86]. Оказалось, что карбоксилированный продукт (107) относительно нестабилен, особенно при кислых pH. Поэтому его превращали в метиловый эфир (108) обработкой диазометаном. Протеолитическое расщепление дало Л -метоксикарбонилбиотин (109), структура которого однозначно установлена рентгеноструктурным анализом [79] схема (67) . [c.621]
Биотин, представляющий собой фактор роста дрожжей и-человека (витамин Н), был впервые выделен Коглем сго-структура показана на схеме 8.13. Биотин выполняет функции кофермента в реакциях карбоксилирования [c.209]
Биотин присоединяется к ферменту амидной связью, образованной карбоксильной группой биотина и аминогруппой входящего в состав фермента остатка лизина. Реакция карбоксилирования, катализируемая биотином, протекает в соответствий со схемой (8.19), где в роли RH обычно выступает ацильная группа ацилированного кофермента А. Биотин-зависимое ферментативное карбоксилирование может обладать определенными-преимуществами по сравнению с прямой реакцией ацилированного кофермента А с диоксидом углерода и бикарбонатом, активированными АТР. [c.209]
Реакция постсинтетического карбоксилирования у-карбоксильной группы глутамата играет, кроме того, важную роль в связывании ионов Са молекулой белка, поскольку при этом образуются дополнительные отрицательно заряженные ионы карбоксильных групп. Следует указать, что биотин не участвует в этой реакции карбоксилирования. [c.218]
Реакция протекает в два этапа I—карбоксилирование биотина с участием АТФ и П—перенос карбоксильной группы на ацетил-КоА, в результате чего образуется малонил-КоА [c.383]
Во второй фазе процесса Ыа-карбоксибиотин (X VI) переносит на промежуточный кофермент двуокись углерода, регенерируя при этом биотин (I). Так, например, ацетил-КоА-карбоксилаза катализирует карбоксилирование ацетил-КоА ( III) в малонил-КоА ( IV). Эта реакция является одной из первых стадий биосинтеза жирных кислот [107—1101. [c.454]
В пропионовокислом брожении мы имеем дело с реализацией третьей возможности превращения пирувата — его карбоксили-рованием, приводящим к возникновению нового акцептора водорода — ЩУК. Восстановление пировиноградной кислоты в про-пионовую у пропионовокислых бактерий протекает следующим образом (рис. 54). Пировиноградная кислота карбоксилируется в реакции, катализируемой биотинзависимым ферментом, у которого биотин выполняет функцию переносчика СО2. Донором СОз-группы служит метилмалонил-КоА. В результате реакции транс-карбоксилирования образуются ЩУК и пропионил-КоА [c.225]
Имеются основания предполагать, что биотин входит в состав коэнзима или коэнзимов, участвующих в реакциях обратимого карбоксилирования пировиноградной кислоты (с образованием щавелевоуксусной кислоты стр. 379), декарбоксилирования сукцинил-коэнзима А, а также в некоторых реакциях обмена, вовлекающих аспарагиновую кислоту. [c.170]
На основании этих и некоторых других исследований биотин-зависимое карбоксилирование можно рассматривать как двустадийную реакцию, при которой в качестве проме куточного продукта образуется связанный с ферментом карбоксибиотип [c.236]
Реакция (XI.36) катализируется Л ГФ-заеысмжой пируваткарбоксилазой — ферментом, локализованным в митохондриях. Этот фермент проявляет большое сродство к НСО карбоксилирование биотина, связанного с ферментом, аллостерически активируется под действием ацетил-КоА, вследствие чего равновесие реакции сдвинуто в сторону образования оксалоацетата. В силу этого пируваткарбоксилаза представляется весьма вероятным кандидатом на роль важнейшего катализатора в синтезе дикарбоновых кислот (и углеводов). Фермент наиболее активен в условиях, когда организм нуждается в максимальной окислительной активности и в производстве энергии. [c.299]
Биохимия Том 3 (1980) — [
c.334
]
Источник
К витаминам
группы К, согласно номенклатуре биологической химии, относятся 2 типа хинонов с
боковыми цепями, представленными изопре-ноидными звеньями (цепями): витамины К1
и К2 . В основе циклической структуры обоих витаминов лежит кольцо
1,4-нафтохинона. Заметим, что животные ткани наделены способностью синтеза
боковых изопреновых цепей, но не могут синтезировать нафтохиноновый компонент.
У большинства бактерий витамин К является компонентом дыхательной цепи вместо
убихинона.
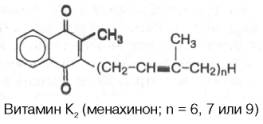
Для витамина
К1 сохранено название «филлохинон», а для витаминов группы К2
введено название «менахинон» с указанием числа изопреновых звеньев
. В частности, для витамина К2 рекомендовано название
«мена-хинон-6», где цифра 6 указывает число изопреновых звеньев в боковой цепи.
Витамин K1(филлохинон) впервые был изолирован из люцерны. Это производное
2-метил-1,4-нафтохинона, содержащего в 3-м положении фитильный радикал, имеющий
20 атомов углерода:
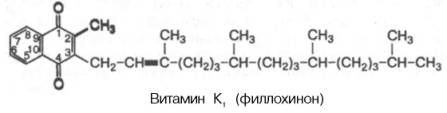
Витамин К2
открыт в растениях и в организме животных и содержит в боковой цепи от 6 до 9
изопреновых единиц.

Витамин K1представляет собой светло-желтую жидкость, неустойчивую при нагревании в
щелочной среде и при облучении, а витамин К2 – желтые кристаллы; он
также неустойчив. Оба препарата нерастворимы в воде, но хорошо растворимы в
органических растворителях: бензоле, хлороформе, ацетоне, гексане и др.
Помимо витаминов K1и К2, некоторые
производные нафтохинона обладают витаминными свойствами и высокой
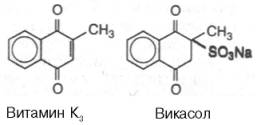
антигеморрагической активностью. Так, синтетический аналог витамина К, лишенный
боковой цепи в положении 3, называют витамином К3 (менадион, или
2-метил-1,4-нафто-хинон); фактически он является провитамином. Поскольку
витамин К3 нерастворим в воде, на его основе были синтезированы
десятки растворимых в воде производных, одно из которых нашло широкое
применение в медицинской практике – это синтезированная А . В . Палладиным
натриевая соль бисульфитного производного витамина К3 – викасол :
Витамин К
является антигеморрагическим фактором, определенным образом связанным со
свертыванием крови: он существенно удлиняет его период. Поэтому при авитаминозе
К возникают самопроизвольные паренхиматозные и капиллярные кровотечения
(носовые кровотечения, внутренние кровоизлияния). Кроме того, любые поражения
сосудов (включая хирургические операции) при авитаминозе К могут привести к
обильным кровотечениям. У человека авитаминоз К встречается реже, чем другие
авитаминозы. Объясняется это двумя обстоятельствами: во-первых, смешанная пища
довольна богата витамином К (витамины группы К синтезируются в зеленых
растениях и некоторыми микроорганизмами); во-вторых, синтезируемого кишечной
микрофлорой количества витамина К вполне достаточно для предотвращения
авитаминоза. Авитаминоз обычно развивается при нарушении процесса всасывания
жиров в кишечнике. У детей грудного возраста часто возникают обильные подкожные
кровотечения и кровоизлияния; они наблюдаются и при так называемом
геморрагическом диатезе, являющемся следствием недостаточности свертывания
крови у матери.
Биологическая роль. Витамин К принимает участие в синтезе протромбина в печени,
вероятнее всего, через ферментную систему. Получены доказательства, что витамин
К необходим как стимулятор биосинтеза в печени минимум 4 белков-ферментов,
участвующих в сложном процессе свертывания крови: факторов II, VII, IX, X. В
частности, имеются данные, что в молекуле указанных факторов обязательно
присутствуют остатки карбоксиглутаминовой кислоты; в молекуле активного
протромбина таких остатков оказалось 10. Протромбин, являясь протеолитическим
ферментом, расщепляет специфические пептидные связи растворимого белка крови
фибриногена с образованием нерастворимого фибрина (см. главу 17). Показано, что
γ-карбоксилирование остатков глутаминовой кислоты в молекуле белков, в
частности протромбина, протекает посттрансляционно при участии
γ-глутамилкарбоксилазы, требующей наличия витамина К; источником СО2
является НСО3–. В этой реакции витамин К выполняет,
по-видимому, кофакторную функцию.
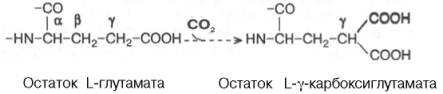
Реакция
постсинтетического карбоксилирования γ-карбоксильной группы глутамата
играет, кроме того, важную роль в связывании ионов Са2+ молекулой
белка, поскольку при этом образуются дополнительные отрицательно заряженные
ионы карбоксильных групп. Следует указать, что биотин не участвует в этой
реакции карбоксилирования.
Одним из
мощных антивитаминов К является природное вещество дикумарол (дикумарин).
Введение его вызывает резкое снижение в крови протромбина и ряда других
белковых факторов свертывания крови и соответственно вызывает кровотечения.
Аналогичным свойством в качестве антикоагулянта обладает синтетический аналог витамина
К варфарин, который действует как конкурентный ингибитор тромбообразования.
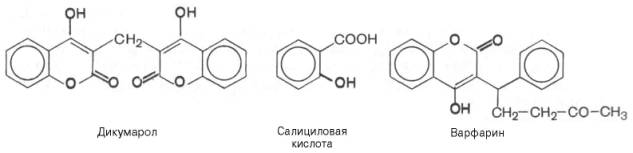
Способность
дикумарола и варфарина снижать свертываемость крови в дальнейшем стали широко
использовать для лечения болезней человека, характеризующихся повышенной
свертываемостью крови. В частности, при коронарных тромбозах, тромбофлебитах
оба эти препарата способствуют разжижению сгустка крови, оказывая эффективное
лечебное действие. В случае возникновения кровотечения после введения
дикумарола или варфарина больным назначают препараты витамина К.
Распространение в природе и суточная потребность. Наиболее богаты витамином К растения, в
частности зеленые листья каштана, крапивы, люцерны. К растительным продуктам,
богатым витамином К, относятся капуста, шпинат, тыква, зеленые томаты,
арахисовое масло, ягоды рябины и т.д. В животных продуктах, кроме печени
свиньи, он почти нигде не содержится. Суточная потребность в витамине К для
человека точно не установлена, поскольку он синтезируется микроорганизмами
кишечника; считается достаточным количество около 1 мг.
Источник
Витамин К является жирорастворимым витамином. Витамин К принимает участие в метаболизме костной и соединительной ткани, отвечает за процесс свертывания крови. Существует в трех изоформах: витамин К1 (филлохинон), витамин К2 (менахиноны) и витамин К3 (менадион), которые отличаются друг от друга длиной и насыщенностью боковой цепи. К1 и К2 являются природными формами витамина К, К3 — синтетической и присутствует только в добавках.
Витамин К1 синтезируется растениями, поэтому основными источниками являются темно-зеленые листовые овощи, растительные масла. Витамин К2 является продуктом жизнедеятельности бактерий и содержится в сброженных продуктах и продуктах животного происхождения. Незначительная часть витамина К2 синтезируется в толстом кишечнике. Считается, что менахиноны вносят меньший вклад, чем филлохинон, в общее потребление витамина К в современном рационе.
Витамин К2 представлен несколькими химическими вариантами (витамеры), которые сокращенно называются MK-n, где «n» указывает количество изопренильных звеньев в боковой цепи. Наиболее распространенной МК у человека является короткоцепочечный МК-4, образуется в результате превращения К1 в МК-4. Длинноцепочечные формы МК, МК-7 до МК-10, встречаются реже в организме человека. Когда количество изопренильных звеньев в боковой цепи молекулы витамина равно 0, это химическая формула называется витамином К3.
Абсорбция и выведение
Витамин К, поступающий с пищей, всасывается в тонком кишечнике. После всасывания обе формы витамина попадают в печень. Большая часть витамина К1, поглощенная печенью, метаболизируется и выводится из организма. Сравнительно небольшое количество витамина К1 вновь попадает в системный кровоток. Витамин К2 транспортируется во внепеченочные ткани и кости. Короткоцепочные формы МК-4 хранятся в мозге, репродуктивных органах, поджелудочной железе и других железах, депо для длинноцепочных форм является печень. Запасы витамина К малы, поэтому организм многократно использует витамин К, уменьшая потребность в нем. С возрастом всасывание витамина К снижается. Наличие хронических заболеваний кишечника, прием антибиотиков, непрямых антикоагулянтов и других лекарств негативно сказывается на поглощении витамина клетками кишечника.
Функции витамина К
Витамин К необходим для правильной работы витамин К-зависимых белков, которых в организме порядка 14. К ним относятся факторы свертывания крови (VII, IX, X, протромбин), протеин С, протеин S, образующиеся в печени; трансмембранные белки; белки костной ткани — остеокальцин, MGP. Витамин К2 играет роль кофактора в реакциях карбоксилирования витамин К-зависимых белков костей.
Витамин К-зависимые белки
Остеокальцин — это один из распространенных неколлагеновых белков костного матрикса. Остеокальцин образуют остеобласты. В процессе синтеза и секреции белка остеокальцина происходит связывание с кристаллами гидроксиапатита. Реакция связывания зависит от присутствия витамина К2. Наличие витамина К2 обеспечивает протекание реакции активации остеокальцина и перехода его в связанную форму, тем самым обеспечивая нормальную минерализацию костей. Небольшая часть остеокальцина выходит в кровоток, 40% циркулирующего остеокальцина находится в недокарбоксилированной форме. Остеокальцин крови является маркером формирования костной ткани и позволяет косвенно судить о процессе ремоделирования кости. Повышение концентрации остеокальцина указывает на повышение скорости костного обмена и связано с такими состояниями как остеопороз, гиперпаратиреоз, хроническая почечная недостаточность, диффузный токсический зоб, опухоли и метастазы, быстрый рост у подростков. Низкие значения остеокальцина говорят о снижении скорости костного обмена. Такие состояния наблюдаются при остеопорозе, вызванным применением глюкокортикоидами, гипопаратиреозе, болезни и синдроме Иценко-Кушинга, дефиците соматотропного гормона.
Белок Matrix Gla (MGP) обнаружен в хряще, кости и мягких тканях, включая стенки кровеносных сосудов. MGP появляется раньше, чем остеокальцин и связывается как с органическими, так и с гидроксиаппатитовыми кристаллами кости. Активация MGP предотвращает отложение Са2+ и замедляет процесс кальцификации в хряще, стенке сосудов, волокнах кожи и трабекулах глаза.
Протеин S, является активатором протеина C, синтезируется остеогенными клетками. Протеин S принимает участие в регулировании костного метаболизма, изменяя активность остеокластов.
Дефицит витамина К
Дефицит витамина К1 и К2 приводят к длительным кровотечениям и снижению минеральной плотности кости, что подтверждается удлинением протромбинового времени и увеличением доли недокарбоксилированных форм остеокальцина крови, соответственно.
Витамин К2 и остеопороз
Ряд исследований, проведенных на культуре клеток, показали, что витамин К2 оказывает анаболическое действие на костную ткань, стимулируя дифференцировку остеобластов и предотвращая образование остеокластов. Однако в исследованиях с участием людей не все так однозначно.
Было доказано, что потребление менее 100 мкг витамина К2 ассоциировано со снижением минеральной плотности костной ткани. Повышение недокарбоксилированных форм остеокальцина в сыворотке крови коррелирует с риском перелома шейки бедра и низкой минеральной плотностью бедренной кости у женщин в постменопаузе и пременопаузе. Однако позже стали появляться новые данные, показывающие, что дополнительный прием витамина К2 никак не влияет на плотность костной ткани у мужчин. Результаты самого большого и длительного исследования с использованием МК-4 доказали, что витамин оказывает положительное влияние только у женщин с запущенным остеопорозом.
Другая группа исследований, в котором изучались совместные влияния витамина К2 и витамина Д, продемонстрировала положительное влияние обоих витаминов на здоровье костей. Использование витаминов К2 и Д предотвращает потерю костной массы и снижает частоту переломов во всех случаях.
Витамин К2 и сердечно-сосудистые заболевания
Сердечно-сосудистые заболевания являются основной причиной смертности у людей старше 65 лет. Кальцификация коронарных артерий является показателем субклинических форм сердечно-сосудистых заболеваний и предсказывает появление инфаркта, инсульта в будущем. Витамин К2 подавляет кальцификацию сосудов с помощью белков GLa. Активация белков предотвращает осаждение кальция в стенке сосудов и хрящевой ткани.
В крупном исследовании, где принимали участие 4807 пациентов без инфаркта миокарда на начальном этапе, анализировались результаты потребления витамина К2 в течение 7 лет. Было показано значительное снижение риска ишемической болезни сердца, смертность от всех причин, тяжелой кальцификации аорты. В другом крупном исследовании с периодом наблюдения 8 лет было доказано, что увеличение потребления К2 на каждые 10 мкг способствует снижению коронарных событий на 9%.
Витамин К и углеводный обмен
Высказывается предположение о том, что добавка витамина К2 может улучшать состояние гликемического профиля и использоваться на определенном этапе терапии метаболических нарушений, включая сахарный диабет.
Недавнее исследование показало, что применение 30 мг витамина К2 повышает чувствительность тканей к инсулину у здоровых молодых людей посредством влияния на метаболизм остеокальцина. Плазменные уровни остеокальцина обратно пропорциональны уровню глюкозы натощак и через 2 часа после нагрузки. У женщин и мужчин с установленным диагнозом сахарный диабет, уровень остеокальцина обратно коррелировал с массой жировой ткани и уровнем гликированного гемоглобина.
К2 улучшает чувствительность к инсулину за счет вовлечения остеокальцина, зависимого от витамина К, противовоспалительных свойств и гиполипидемических эффектов.
Источник
