Методика определения водорастворимых витаминов вэжх
Водорастворимые витамины на ВЭЖХ Agilent 1200
FeroxDS » Пн авг 12, 2013 7:09 am
Доброго времени суток колеги. Задавал свой вопрос на других форумах, но ответ пока не получил,
может здесь мне помогут.
Не так давно у нас сократился штат, и меня отправили в лабораторию химического анализа осваивать ВЭЖХ. Сейчас основной задачей является определение водорастворимых витаминов В1, В2, В3, В5 (пантотенат Са), В6 и фолиевой кислоты. Прочитав множества разных методик, остановился на одной из них, результаты получаю, но они какие-то не однозначные. Стандартные растворы дают нужные пики, стабильность и повторяемость присутствует, но когда прокалываю образцы пики во первых смещаются, а во вторых результаты сильно пляшут, как в меньшую так и в большую сторону.
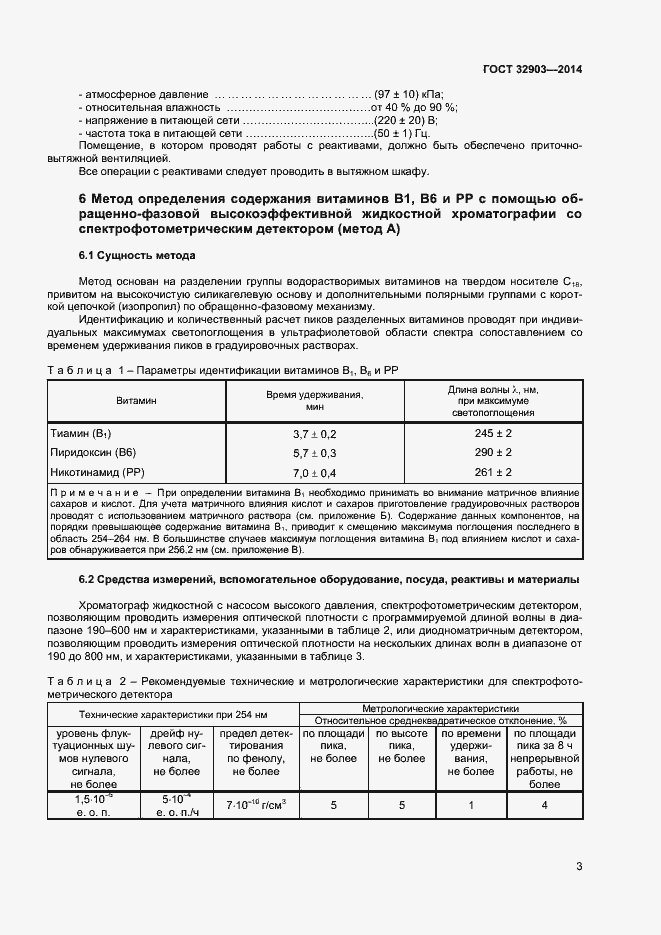
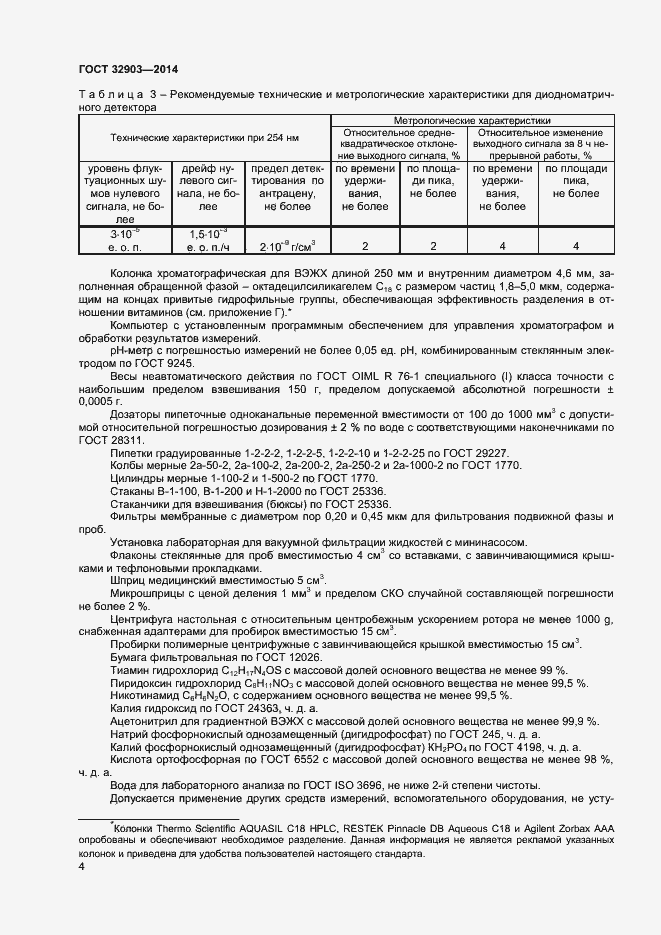
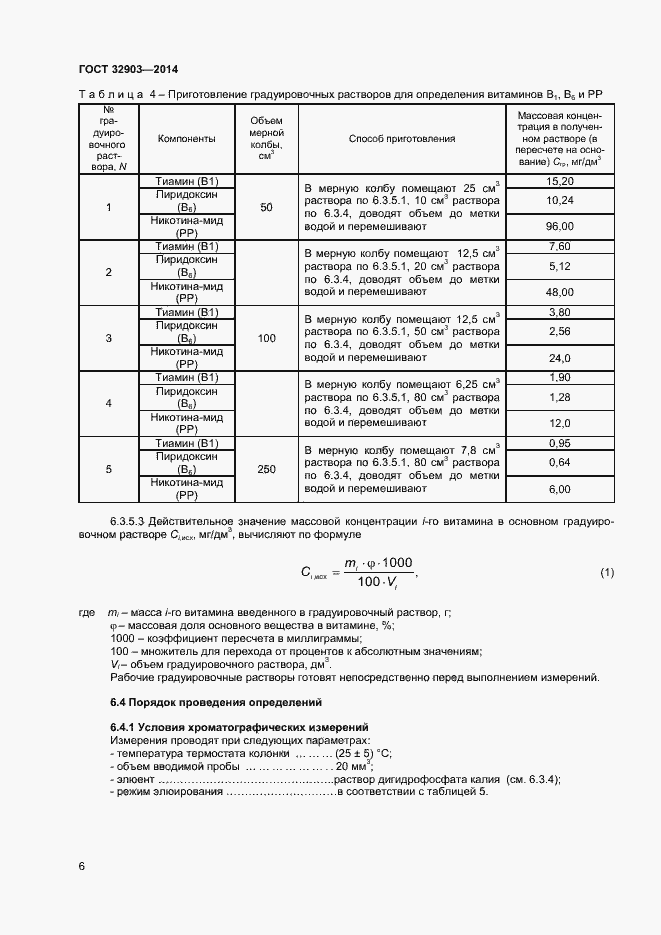
Очень хотел бы получить от вас помощи или совета. Ниже методика, по которой я работаю.
ВЭЖХ agilent 1200 с VWD и FLD детекторами, Колонка Zorbax SB-C18 4,6х150мм 3,5мкм
Подвижная фаза А – ACN
Пподвижная фаза В – Н2О Рh 3,0 доведенная H2SO4(по методике 2,0, но я побоялся испортить колонку поэтому ставлю 3,0)
Стандартные растворы витаминов готовлю из расчета 50мг на 50мл. Так чтобы концентрация была 1мг на 1 мл. Для каждого витамина отдельно
Рабочий стандартный раствор: 20мкл Стандартного раствора (каждого из шести витаминов) + 880мкл HCl 0,1М. Таким образом стандарт для прокола содержит по 20мкг каждого из витаминов.
Характеристики вкола: Вкол 20мкл; поток 1,5 мл; градиент 0-3мин 2%А + 98%В, 3,5-10мин 20%А + 80%В (градиент подбирал эмпирически); длина волны VWD — В1, В3 — 244нм, В2, ФК — 262нм, В6-292нм, В5 (пантотеновая к-та) 200нм.
Делаю в среднем 5 проколов стандарта для насыщения колонки, и пока выходящие пики не станут стабильными, после чего запускаю образцы для исследования.
Вот тут и начинаются проблемы, методы для извлечения витаминов для разных групп продуктов разные (молочные, премиксы, бады и т.д.). Пытался делать и по Скурихину и по ГОСТам и по другим методикам и всегда результаты разные. Остановился на одной методике: 1г продукта + 10мл HCl 0,1М, все это гомогенизирую, растворяю (по мере возможности), помещаю в пробирку с прикручивающийся крышкой, и ставлю при 65С на твердотельный термостат 10мин. Затем на УЗ Баню 15 мин, после чего фильтрую, ц-фугирую при 8тыс обор/10мин., отбираю 200мкл фильтрата и довожу до 1мл 0,1М HCl . Собственно, это и вкалываю. При получении результатов количество некоторых витаминов может сильно отличаться как в большую, так и в меньшую стороны.
Подскажите, где я допускаю ошибку?
Заранее благодарю! С уважением.
FeroxDS
Новичок
Сообщения: 1Зарегистрирован: Пн авг 12, 2013 6:57 am
Re: Водорастворимые витамины на ВЭЖХ Agilent 1200
Константин Сычев » Пн авг 26, 2013 10:57 am
Добрый день!
Ошибки в подготовке пробы вроде нет. Кипятите разве что подольше, и даже в самой сложной матрице они рано или поздно растворятся. Ну, в кислой среде никотиамид до никотинки чуть повалится, а так все остальные должны это пережить.
Есть у Вас небольшое непонимание уровня сложности задачи именно в плане хроматографии.
Дело в том, что групповое определение в ВЭЖХ стандартными методами в сложных матрицах — это вообще нетривиальная задача. Когда матрица сложная, то как правило:
— все делают в изократическом режиме, настраивая…
— … разделение на одно вещество, причем…
— … по возможности используя две дублирующие системы в разных ВЭЖХ режимах.
Т.е. то, на что Вы замахнулись — это высший пилотаж. Если он получается))) но в реальности такие методики не применяют, потому что методика прежде всего должна быть воспроизводима в любых условиях.
У нас, кстати, наборы на ВЭЖХ витамины есть. Вот можно посмотреть здесь:
viewforum.php?f=47
Тут об анализаторе, но мы продаем и наборы для определения на любом приборе. НО! опять же, эти методики настроены на быстрый групповой анализ витаминных препаратов, т.е. на самые легкие матрицы. С учетом сложных матриц их нужно немного адаптировать.
А какие вещества не получаются — я, наверное, угадаю))) не получаться должны В1 и В5.
В1 — потому что тиамин просто не удерживается в приведенной системе. Т.е. в приведенных условия В1 вообще нельзя определять.
В5 — потому что неселективная длина волны, низкое поглощение. Любая фитюлька из матрицы легко «накроет» этот пик с головой — не говоря уже о точной количественном определении.
Т.е. погрешность — скорее в хроматографии, а не в пробоподготовке. Задача значительно сложнее, чем Вы могли предполагать. Сначала нужно отладить надежное ВЭЖХ разделение (например, на одном реальном образце с добавками). И уже потом переходить на игры с пробоподготовкой.
С уважением,
к.х.н., Константин Сычев
Константин Сычев
Специалист
Сообщения: 338Зарегистрирован: Чт дек 09, 2010 10:10 am
Re: Водорастворимые витамины на ВЭЖХ Agilent 1200
Клим » Чт дек 12, 2013 8:58 am
В случае разделения витаминов группы В (и фолиевой кислоты в том числе) может помочь ион-парная хроматография.
Элюент А — 0,94 г гептилсульфоната натрия, 2,7 г дигидрофосфата калия, 1,25 мл уксусной кислоты, 25 мкл триэтиламина (расчет на 500 мл)
Элюент Б — вода + ацетонитрил (1:1)
Режим элюирования: 0-3,5 мин — 5%В, 3,5-15 мин прямой градиент 5-95%В.
Анализ проводился на приборе Милихром-А02 (колонка ProntoSIL 75 мм), в Вашем случае думаю стоит пересмотреть режим элюирования.
Применяли данную методику для разделения янтарной кислоты, никотинамида и рибофлавина, все прекрасно пошло, идеальная воспроизводимость.
А…да… и обязательно (!) перед анализом промыть колонку фазой А 10-кратным объемом колонки.
Клим
Новичок
Сообщения: 7Зарегистрирован: Ср дек 11, 2013 12:07 pm
Re: Водорастворимые витамины на ВЭЖХ Agilent 1200
Константин Сычев » Вс дек 29, 2013 10:16 am
Клим, извините, но не могу не вмешаться. В применяемой системе допущено сразу несколько ошибок. Вы добились разделения трех пиков на требуемом уровне концентраций на одной колонке. Но это не значит, что кто-то другой это воспроизведет у себя.
Во-первых, Вы даже толком не зашли в ион-парный режим. Гептил-сульфонат — это очень слабый реагент. Он просто смывается сильной ступенью градиента, т.е. никакого ион-парного режима просто не получается.
Во-вторых, градиентный режим не сочетается с применением добавок, поглощающих в УФ области. А тут все поглощает: и триэтиламин, и кислота… Чтобы хоть что-то увидеть в такой системе, концентрации нужны (особенно янтарной кислоты) просто ломовые.
В-третьих, для разделения этих трех пиков вообще не нужны никакие добавки кроме буфера. Янтарная и В3 выходят просто на подкисленной подсоленной воде, а В2 домывается легким градиентом. Если для буфера применять фосфаты, то зачем туда заливать уксусную кислоту? Подкислите фосфорной… А триэтиламин тут вообще ни при чем…
С уважением,
к.х.н., Константин Сычев
Константин Сычев
Специалист
Сообщения: 338Зарегистрирован: Чт дек 09, 2010 10:10 am
Re: Водорастворимые витамины на ВЭЖХ Agilent 1200
Клим » Ср янв 29, 2014 9:51 am
Здравствуйте, Константин!
В Вашей книге «Практический курс жидкостной хроматографии» 2013 года на странице 41 написано, что алкилсульфонаты — хорошие ион-парные реагенты. Как понимать Вашу фразу «Вы даже толком не зашли в ион-парный режим»???
Что касается градиентного элюирования…. В начале анализа у нас была ступенька изократики с 5% ацетонитрила для удерживания янтарной кислоты и для того чтобы не смыть модификатор, витамины же группы В при таком раскладе вышли бы либо очень поздно, либо размытыми пиками. Именно поэтому далее начинали градиентное элюирование.
Содержание янтарной кислоты в нашем препарате исчисляется милиграммами, а не нанограммами, поэтому с учетом ее плохого поглощения и/или поглощения примесей (из кислоты, триэтиламин) она в любом случае детектируется.
Чтобы увидеть посторонние примеси из подвижной фазы, различных модификаторов и т.д. проводим так называемый холостой анализ, на хроматограмме подвижной фазы можно исключить таковые примеси.
Просто на подкисленном буфере проводили анализ, янтарная кислота не удерживалась, вылетала в мертвом объеме.
На счет уксусной кислоты…. Заметьте! Я не упоминал слово буфер. Раствор дигидрофосфата калия подкисленный уксусной кислотой. А какой кислотой что подкислять — дело выбора аналитика.
Конечно же важен сорбент, данный анализ получился на ProntoSIL AQ (Милихром-А02), на Supelco (Shimadzu LC-20) не пошел.
С уважением, Леонов Клим.
Клим
Новичок
Сообщения: 7Зарегистрирован: Ср дек 11, 2013 12:07 pm
Источник

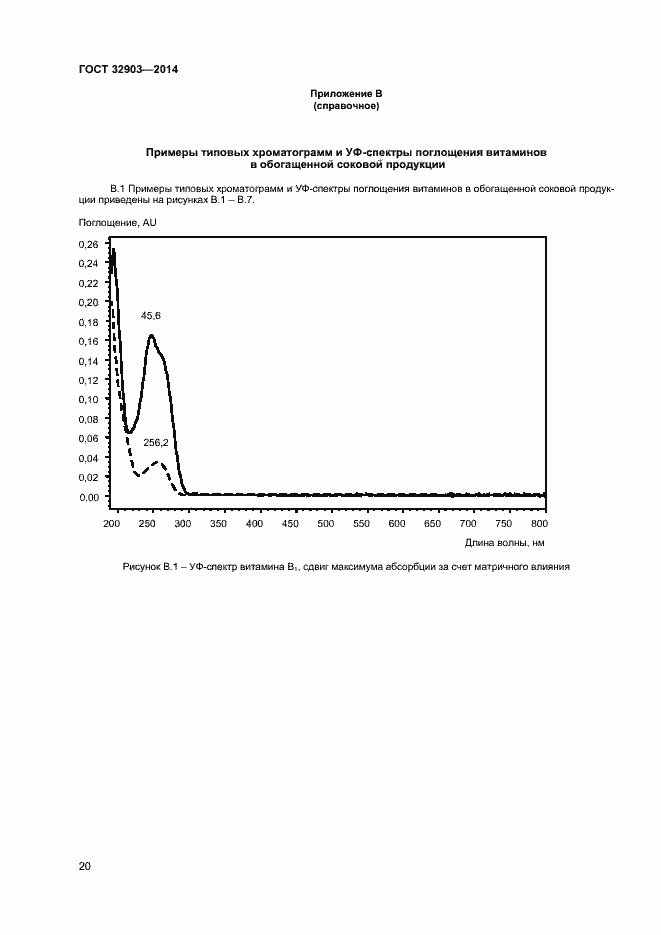
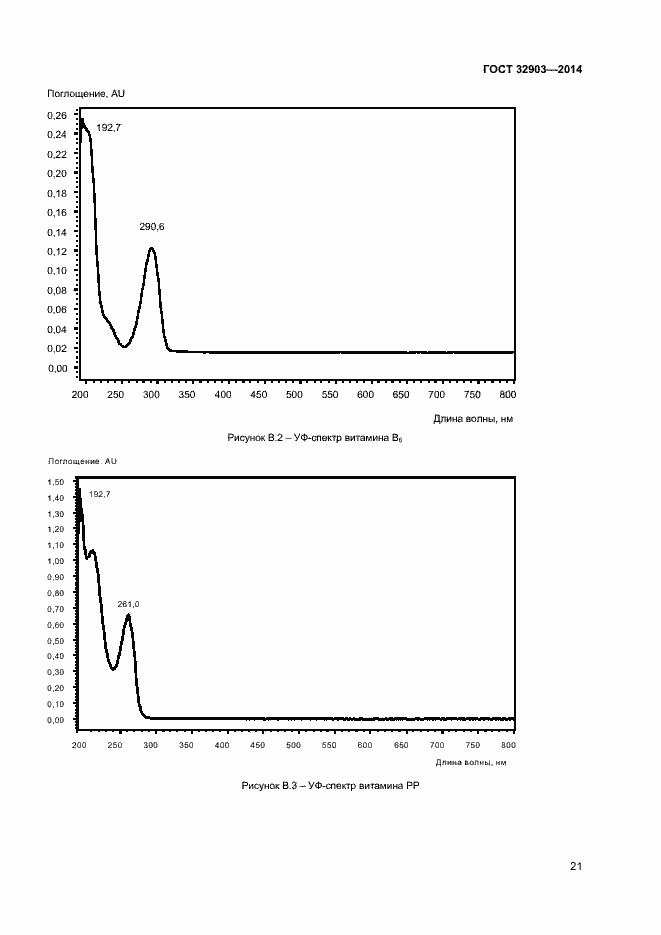
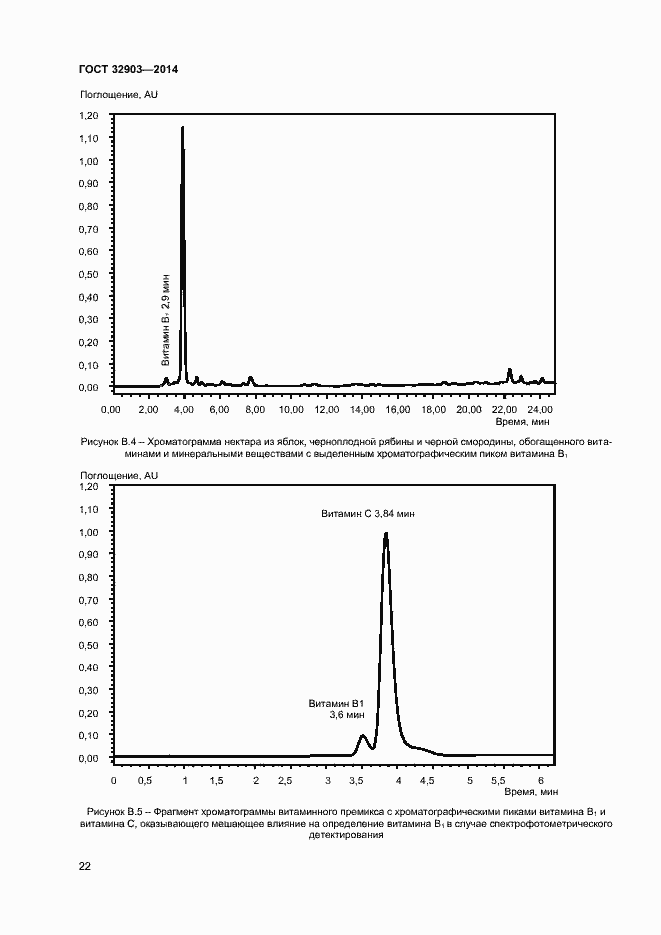
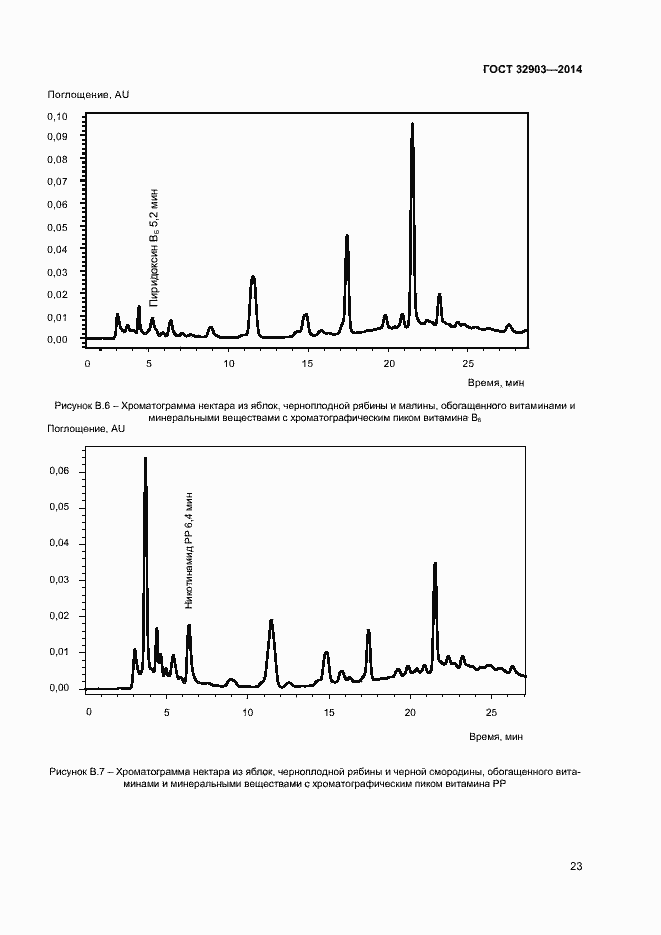
Основные ссылки | Вернуться в «Каталог ГОСТ»Продукция соковая. Определение водорастворимых витаминов: тиамина (B1), рибофлавина (В2), пиридоксина (B6) и никотинамида (PP) методом обращенно-фазовой высокоэффективной жидкостной хроматографии
Вернуться в «Каталог ГОСТ»Источник информации: https://internet-law.ru/gosts/gost/58349/ На эту страницу сайта можно сделать ссылку: На правах рекламы: Произвольная ссылка: |
© Антон Серго, 1998-2020. | Разработка сайта |
Источник
 ГОСТ 32903-2014
ГОСТ 32903-2014
Продукция соковая. Определение водорастворимых витаминов: тиамина (B1), рибофлавина (В2), пиридоксина (B6) и никотинамида (PP) методом обращенно-фазовой высокоэффективной жидкостной хроматографии
| Обозначение: | ГОСТ 32903-2014 |
| Обозначение англ: | GOST 32903-2014 |
| Статус: | введен впервые |
| Название рус.: | Продукция соковая. Определение водорастворимых витаминов: тиамина (B1), рибофлавина (В2), пиридоксина (B6) и никотинамида (PP) методом обращенно-фазовой высокоэффективной жидкостной хроматографии |
| Название англ.: | Juice products. Determination of water-soluble vitamins: thiamine (vitamin B1), riboflavin (vitamin B2), pyridoxine (vitamin B6) and nicotinamide (vitamin PP) by reversed-phase high performance liquid chromatography (HPLC) |
| Дата добавления в базу: | 21.05.2015 |
| Дата актуализации: | 01.02.2020 |
| Дата введения: | 01.01.2016 |
| Область применения: | Стандарт распространяется на соковую продукцию из фруктов и овощей, обогащенную водорастворимыми витаминами B1, B2, B6, РР, и устанавливает методы обращенно-фазовой высокоэффективной жидкостной хроматографии для определения массовой концентрации или массовой доли водорастворимых витаминов в ней. |
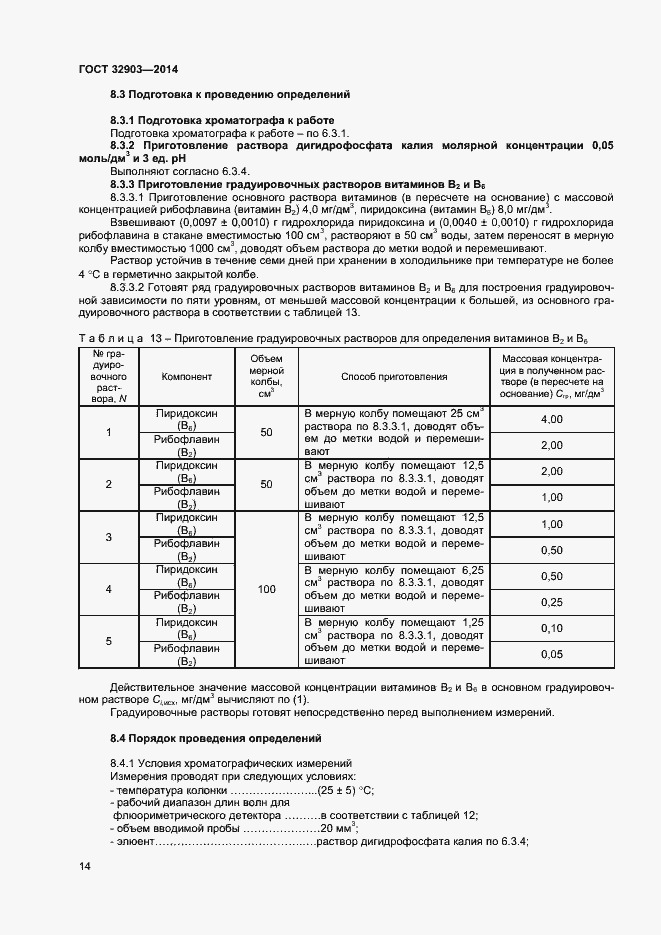
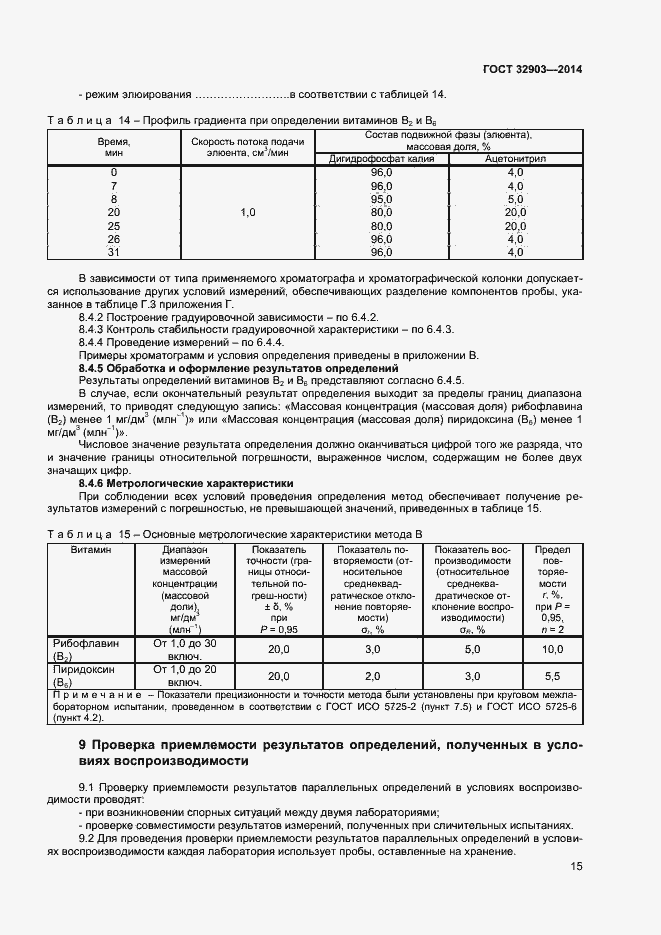
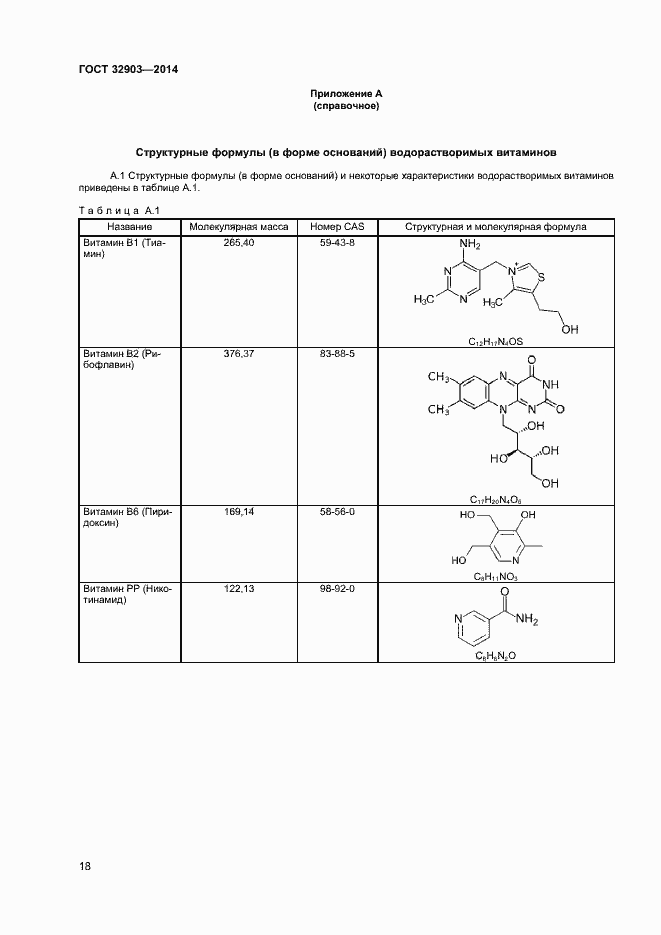
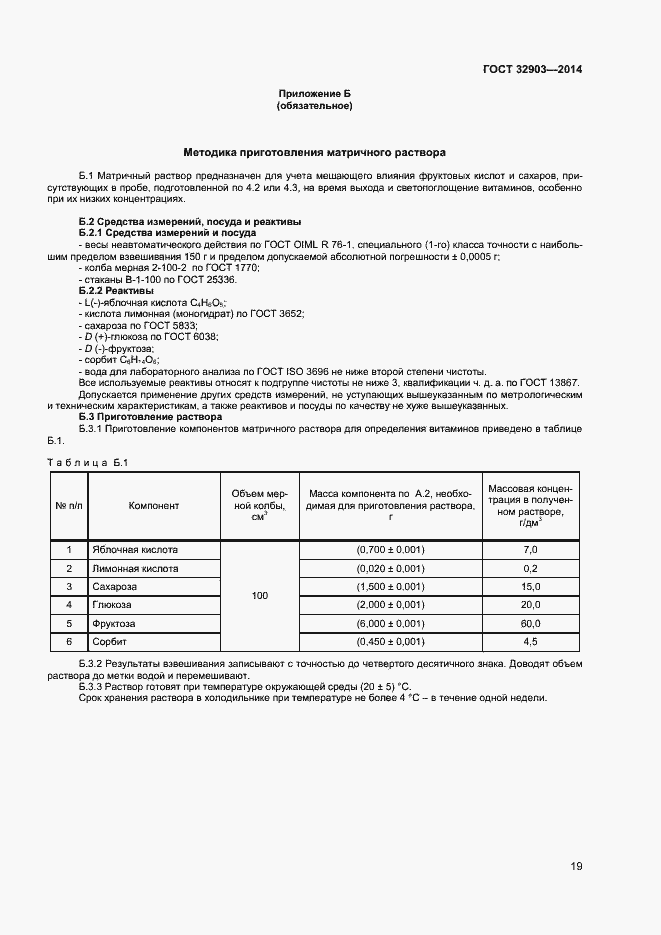
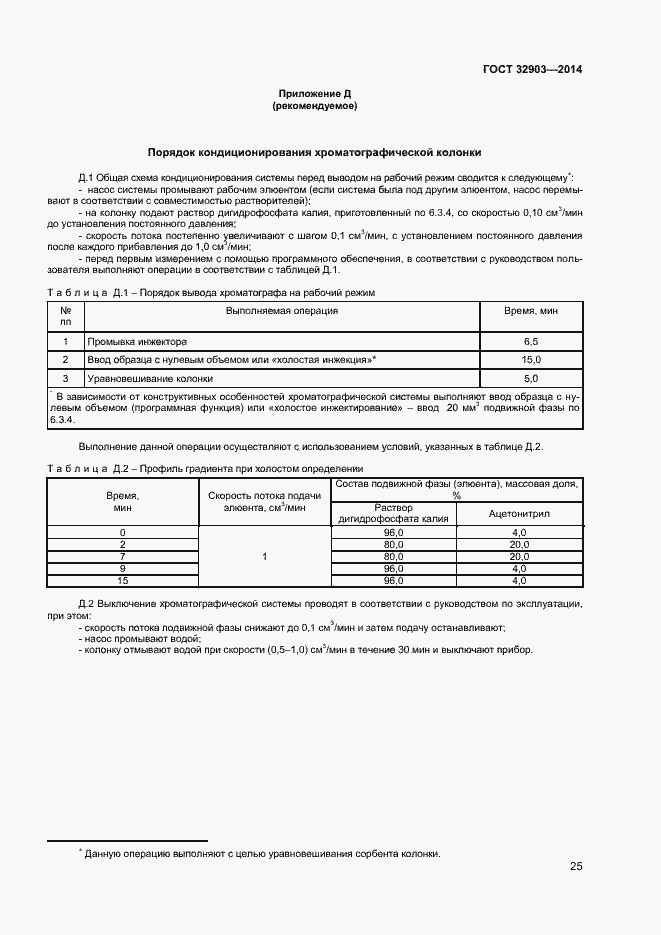
| Оглавление: | 1 Область применения 2 Нормативные ссылки 3 Термины и определения 4 Отбор и подготовка проб 5 Условия проведения определений 6 Метод определения содержания витаминов В1, В6 и РР с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии со спектрофотометрическим детектором (метод А) 7 Метод определения содержания витамина В1 с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии с постколоночной дериватизацией и флюориметрическим детектором (метод Б) 8 Метод определения содержания витаминов В2 и В6 с помощью обращенно-фазовой высокоэффективной жидкостной хроматографии с флюориметрическим детектором (метод В) 9 Проверка приемлемости результатов определений, полученных в условиях воспроизводимости 10 Контроль качества результатов определений при реализации методов в лаборатории 11 Требования безопасности и охраны окружающей среды Приложение А (справочное) Структурные формулы (в форме оснований) водорастворимых витаминов Приложение Б (справочное) Методика приготовления матричного раствора Приложение В (справочное) Примеры типовых хроматограмм и УФ-спектры поглощения витаминов в обогащенной соковой продукции Приложение Г (обязательное) Определение эффективности хроматографической колонки Приложение Д (рекомендуемое) Порядок кондиционирования хроматографической колонки Библиография |
| Разработан: | НО РСПС ЗАО Мултон |
| Утверждён: | 14.11.2014 Межгосударственный Совет по стандартизации, метрологии и сертификации (Inter-Governmental Council on Standardization, Metrology, and Certification 72-П) 24.11.2014 Федеральное агентство по техническому регулированию и метрологии (1716-ст) |
| Издан: | Стандартинформ (2014 г. ) |
| Расположен в: | |
| Нормативные ссылки: |
|
Источник
ЖУРНАЛ АНАЛИТИЧЕСКОЙ ХИМИИ, 2010, том 65, № 1, с. 73-78
ОРИГИНАЛЬНЫЕ СТАТЬИ =
УДК 543.544
ОПРЕДЕЛЕНИЕ ВОДОРАСТВОРИМЫХ ВИТАМИНОВ ГРУППЫ В И ВИТАМИНА С В КОМБИКОРМАХ, ПРЕМИКСАХ И БИОЛОГИЧЕСКИ-АКТИВНЫХ ДОБАВКАХ МЕТОДОМ ОБРАЩЕННО-ФАЗОВОЙ ВЭЖХ © 2010 г. А. О. Руденко, Л. А. Карцова
Санкт-Петербургский государственный университет, химический факультет 198504 Санкт-Петербург, Петродворец, Университетский просп., 26 Поступила в редакцию 06.10.2008 г., после доработки 02.03.2009 г.
Разработана методика определения водорастворимых витаминов группы В и витамина С в премиксах, биологически-активных добавках и комбикормах методом обращенно-фазовой ВЭЖХ в режиме градиентного элюирования с использованием гептансульфоната натрия в качестве ион-парного реагента. Разработана методика очистки экстрактов комбикорма методом твердо-фазной экстракции на колонке, заполненной сорбентом 8ер-Рак С18. Изучена устойчивость аскорбиновой кислоты и рибофлавина в водных растворах с различными значениями рН.
В настоящее время существует несколько основных методов определения витаминов в различных объектах. Наибольшее распространение получили хроматографические [1, 2], спектроскопические (ЯМР, УФ-спектроскопия) [3, 4] и электрофорети-ческие [5, 6] методы анализа. Водорастворимые витамины чаще всего определяют обращенно-фазовой высокоэффективной жидкостной хроматографией (ОФ ВЭЖХ) [7]. При анализе водорастворимых витаминов в качестве подвижных фаз обычно используют смеси метанол—вода в различных соотношениях с добавками триэтиламина или ион-парных агентов (гептилсульфонат натрия, октилсульфонат натрия или додецилсульфат натрия) [1].
Введение ион-парных агентов необходимо, поскольку водорастворимые витамины представляют собой гидрофильные соединения, проявляющие большую склонность к протонированию [8]. В качестве элюента используют также смеси ацетонит-рил—фосфатный буферный раствор, ацетонитрил — ацетатный буферный раствор в различных соотношениях [2].
Пробоподготовка реальных объектов при анализе водорастворимых витаминов обычно заключается в жидкостной экстракции витаминов разбавленным раствором HCl или метанолом [3]. Устойчивость некоторых витаминов (например, аскорбиновой кислоты) в метанольной среде выше, чем в водных растворах. Однако, такие витамины, как рибофлавин, в метаноле растворяются хуже, чем в воде [8]. При анализе сложных биологических и природных объектов возникает проблема очистки экстрактов. Наиболее эффективным методом очистки является твердофазная экстракция (ТФЭ) на различных сорбентах. [9]
Цель настоящей работы — разработка методики определения витаминов группы В и витамина С в премиксах, биологически-активных добавках и комбикормах.
ЭКСПЕРИМЕНТАЛЬНАЯ ЧАСТЬ
В работе использовали бидистиллированную воду, ацетонитрил (ос. ч.) («Криохром», Россия), KH2PO4 («Вектон», Россия), H3PO4 («Вектон», Россия), гептансульфонат натрия моногидрат («Ald-rich», США), а также стандарты витаминов («Sigma», США), сорбенты для твердофазной экстракции: активированный уголь (Россия), XAD2 Amberlite (Supelco, США), Sep-Pak C18 (Waters, США).
Определение витаминов проводили на жидкостном хроматографе Shimadzu LC-20 Prominence, (Япония) с УФ-детектированием (260 и 280 нм). Хроматографическая колонка 250 х 4.6 мм Supelco С18 зернением 5 мкм (США). Хроматографировали в градиентном режиме при расходе элюента 1 мл/мин (табл. 1). В качестве подвижной фазы использовали смесь 11.0 мМ фосфатного буферного раствора с рН 2.5, содержащего 4 об. % ацетонитрила и 10.5 мМ гептансульфонат натрия (компонент А) и ацетонитрил (компонент В).
Использовали стандартные образцы следующих витаминов: аскорбиновая кислота (С), никотиновая кислота (В3 или РР), никотинамид (В3 или РР), пиридоксин гидрохлорид (В6), рибофлавин (В2), тиамин гидрохлорид (В1) (рис. 1). Растворы для построения градуировочного графика готовили последовательным разбавлением исходной концентрированной смеси указанных витаминов.
Таблица 1. Условия градиентного элюирования
Время, мин Объемная доля компонента, %
А В
0.01 93 7
6.5 93 7
9 82 18
13 82 18
17 50 50
19.5 50 50
22 93 7
25 93 7
При определении витаминов в премиксах, комбикормах и БАД образцы экстрагировали 25 мл 0.01 М раствора соляной кислоты при 40°С в течение 10 мин. Полученную взвесь центрифугировали в течение нескольких мин при 8000 об/мин. С целью снижения фонового сигнала, удаления примесей и сопутствующих компонентов, а также получения удовлетворительных значений разрешения RS пиков экстракт комбикорма очищали методом твердофазной экстракции. Изучены различные сорбенты: XAD2 ЛшЪегШе, Supelco (60 мкм, емк. 10.5%),
Sep-Pak C18, Waters (20 мкм, емк. 12%) мелкораздробленный активированный уголь (БАО) с диаметром гранул 1.5 мм и полистирол (100 мкм). Экстракт очищали на стеклянной колонке с внутренним диаметром 4—5 мм, заполненной сорбентом на высоту 3—4 см. Поверх сорбента помещали фильтр из стекловаты. Сорбент предварительно промывали 5 мл метанола и 5 мл дистиллированной воды. Затем в колонку вводили 3 мл экстракта комбикорма и пропускали его через колонку под вакуумом водоструйного насоса со скоростью ~0.5 мл/мин. Сорбент промывали 1 мл дистиллированной воды. Витамины десорбировали 3 мл метанола. Полученный элюат упаривали под вакуумом досуха и растворяли в 1 мл элюента. Вследствие высокого содержания примесей в экстракте комбикорма сорбент в колонке использовали один раз. Очищенные экстракты фильтровали через мембранный фильтр с диаметром пор 0.45 мкм («Supelco», США). Для определения коэффициентов извлечения в экстракт комбикорма вводили добавку стандартной витаминной смеси до процедуры очистки и анализировали экстракты с добавкой и без добавки. Коэффициент извлечения а определяли по формуле
а =
( S — So ) V V
ад v4 ,
(1)
где: и S1— средняя площадь пика компонента в пробе без добавки и с добавкой соответственно, см2; У1 — конечный объем очищенного экстракта (1 мл), к — градуировочный коэффициент компонента; с0 — концентрация компонента в добавленном растворе ( 0.2 мг/мл),; У2 — объем добавленного рабоче-
CO-
C-OH и
C-OH
H-HO-
-о—
H
CH2OH I
H3C H3C
N
O
OH
II
CH2OH
I 2
CHOH CHOH CHOH
CH2
I 2
C
Л .NH
N C
II
O
N
Г
O
O
V
nh2
N
CH2OH HOH2C OH
CH3
III
N IV
© ch3
гч 1
N-CH H2 C>/C=C-CH2CH2OH H3C^ У—C-N ‘
N:
HC-S
nh2
VI
Рис. 1. Структуры определяемых витаминов: I — аскорбиновая кислота, II — никотиновая кислота, III — никотинамид, IV — пиридоксин, V — рибофлавин, VI — тиамин
го раствора витаминов (3 мл), У3 — суммарный объем экстрагента (25 мл), У4 — объем очищаемого экстракта (3 мл). Коэффициенты извлечения витаминов в составе комбикорма ПК-5 приведены в табл. 2.
Хроматограммы экстрактов реальных объектов приведены на рис. 2—4.
Массовую долю витаминов в комбикормах, премиксах и БАД (Х,, мг/кг), вычисляли по формуле
Таблица 2. Коэффициенты извлечения витаминов на сорбенте Sep-Pak C18 (n = 5, P = 0.95)
X =
сУк n
m н а
(2)
где с — концентрация витамина, полученная по гра-дуировочному графику, мг/см3; Ук —объем HCl, используемый для экстракции (25 мл).
n — для премиксов и БАД степень разбавления хроматографируемой пробы соляной кислотой в случае выхода за пределы верхнего диапазона определяемых содержаний; n — для комбикормов степень упаривания метанольного экстракта; тн — навеска пробы, взятая для экстракции, кг; а — коэффициент извлечения.
В специальных экспериментах определяли стабильность аскорбиновой кислоты и рибофлавина. Эти витамины наиболее чувствительны к воздействию света и значению рН среды. При длительном хранении градуировочных растворов различной концентрации, приготовленных на бидистиллиро-ванной воде, наблюдали значительное снижение концентрации указанных витаминов.
Витамин а
Никотиновая кислота 0.77 ± 0.04 0.03
Никотинамид 0.86 ± 0.05 0.04
Пиридоксин 0.75 ± 0.04 0.03
Тиамин 0.86 ± 0.05 0.04
Рибофлавин 0.94 ± 0.03 0.03
РЕЗУЛЬТАТЫ И ИХ ОБСУЖДЕНИЕ
Условия градиентного элюирования оптимизировали экспериментально с использованием модельных смесей. Оптимальное разделение наблюдается при содержании ацетонитрила в элюенте 12об.% (табл. 3).
Введение в подвижную фазу гептансульфоната натрия (ион-парный реагент) позволило полностью разделить пики.
Активированный угль и полистирол непригодны в качестве сорбентов для очистки экстрактов мето-
Усл. 1100 1000 900 800 700 600 500 400 300 200 100 0
1 2 3 4 5 6 7 8 9 10 11 12 13 мин
Рис. 2. Хроматограмма экстракта биологически-активной добавки «АлфаВит»: 1 — аскорбиновая кислота, 2 — никотиновая кислота, 3 — никотинамид, 4 — пиридоксин, 5 — рибофлавин, 6 — тиамин. Условия хроматографирования: колонка (250 х 4.6 мм) 8ире1ео811 С18 (5 мкм), элюент—фосфатный буферный раствор с рН = 2.5, ацетонитрил, длина волны детектора 260 нм, расход элюента 1 мл/мин.
Усл. ед. 275
250
225
200
175
150
125
100
75
50
25
20.0 7, мин
Рис. 3. Хроматограмма экстракта премикса П-50: 1 — никотиновая кислота, 2 — никотинамид, 3 — пиридоксин, 4 — рибофлавин, 5 — тиамин. Условия хроматографирования указаны в подписи под рис. 2.
дом ТФЭ. На сорбенте ХАЛ2 АшЪегШе удалось очистить экстракт от слабоудерживаемых примесей, однако пиридоксин (В6), тиамин (В1) и аскорбиновая кислота практически не удерживались. Лучшие результаты по эффективности очистки и коэффициентам извлечения показал обращенно-фазовый сорбент 8ер-Рак С18, благодаря которому удалось значительно снизить пределы обнаружения аналитов, а также получить удовлетворительные результаты по коэффициентам извлечения (табл. 2) и разрешению (табл. 3). При этом установлено, что колонка с сор-
бентом 8ер-Рак С18 для ТФЭ не выдерживает многократного использования.
Аскорбиновую кислоту вследствие ее высокой гидрофильности и слабой устойчивости в водных растворах определить в этих условиях не удалось. Коэффициенты извлечения имели крайне низкое значение (~30%) и не воспроизводились от пробы к пробе. Изучена устойчивость водорастворимых витаминов — аскорбиновой кислоты и рибофлавина — в водных средах с различными значениями рН при температуре 20°С (рис. 5). Установле
Для дальнейшего прочтения статьи необходимо приобрести полный текст. Статьи высылаются в формате PDF на указанную при оплате почту. Время доставки составляет менее 10 минут. Стоимость одной статьи — 150 рублей.
Источник












 ГОСТ 12.1.007-76 «Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности»
ГОСТ 12.1.007-76 «Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности»