Коферментные функции витаминов трансаминаз и дегидрогеназ
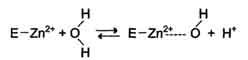
Кофакторы ферментов: ионы металлов и коферменты.
Активность ряда ферментов (простые белки) в норме зависит только от их структуры, тогда как для других, названных холоферментами (сложные белки), требуются кофакторы — вещества небелковой природы, в роли которых могут быть сложные органические соединения (коферменты) и ионы металлов.
Кофактор может образовывать с апоферментом прочные ковалентные связи. В этом случае кофермент называют простетической группой фермента. Примерами могут служить ФАД, ФМН, биотин, ковалентно связанный с остатком лизина в активном центре, Zn2+, который содержится в активном центре карбоксипептидазы. В том случае, если кофермент связывается с апоферментом нековалентными связями только на время химической реакции (НАД+ и НАДФ+), он может рассматриваться в качестве второго субстрата данного фермента Один и тот же кофермент может участвовать в разных биохимических реакциях, комплементарно связываясь с разными апоферментами. Собственной каталитической активностью коферменты не обладают.
Апофермент формирует активный центр, отвечает за специфичность действия фермента, фиксирует и ориентирует субстрат в активном центре и создает условия для преобразования субстрата в продукты реакции. Ионы металла выполняют две главные функции.
I). Стабилизируют нативную конформацию фермента, структуру его активного центра и субстрата. 2). Участвуют в ферментативном катализе.
1). Металлоферменты, лишенные ионов металла, либо сохраняют способность к химическому катализу, утрачивая стабильность, либо полностью теряют активность. Например, щелочная фосфатаза — металлофермент, в активном центре которого находится Zn2+, лишенная ионов цинка щелочная фосфатаза, теряет ферментативную активность, но восстанавливает ее после добавления металла. В некоторых металлоферментах ион металла (Mg2+, Mn2+, Zn2+, Co2+, Мо2+) участвует в образовании связи между молекулой субстрата и активным центром кофермента. в отсутствие иона эти ферменты не обладают активностью. Ряд ферментов в качестве субстрата используют комплекс превращаемого вещества с ионом. Для большинства киназ одним из субстратов служит не молекула АТФ, а комплекс Mg2+-ATФ.
2). Ферментативный электрофильный катализ. Ионы металла непосредственно участвуют в катализе и локализованы в активном центре фермента.В активном центре ферментов могут содержатся Zn 2+, Mn 2+, Fe 2+, Си 2+. Пример элек-трофильного катализа — действие карбоангидразы, содержащей ион цинка в активном центре.
B6 Коферментные функции выполняют два фосфорилированных производных пиридоксина: пиридоксальфосфат и пиридоксаминофосфат. Распад коферментов идет путем дефосфорилирования и окисления с образованием 4-пиридоксиловой кислоты. которая выводится из организма.
Коферментные формы витамина В6 включены в реакции, катализируемые почти всеми классами ферментов. Наиболее значительная группа пиридоксалевых ферментов — аминотрансферазы. Пиридоксальзависимые (пиридоксалевые ферменты) ферменты катализируют взаимопревращения и распад аминокислот (регулируют аминокислотный состав крови при разном аминокислотном составе пиши), участвуют в специфических реакциях метаболизма отдельных аминокислот (серина, треонина, триптофана). Участвуют в обмене липидов, синтезе сфинголипидов. В качестве кофактора ферментов участвуют в начальных стадиях синтеза гема. Влияют на обмен жирных кислот.
PP — предшественник коферментов -никотинамидадениндинуклеотида (НАД+) и никотинамидадениндинуклеотид-фосфата (НАДФ ), входящих в состав дегидрогеназ и редуктаз.
НАД+ и НАДФ+ приобретают коферментные функции после присоединения к никотинамиду радикала, включающего остаток рибозы, пирофосфат и нуклеотид — аденин. Витамин РР такими функциями не обладает.
1. НАД+ — кофермент дегидрогеназ, участвующих в реакциях окисления глюкозы, жирных кислот, глицерола, аминокислот после их дезаминирования; является коферментом дегидрогеназ цикла Кребса (кроме сукцинатдегидрогеназы). В этих реакциях кофермент выполняет функцию промежуточного акцептора электронов и протонов.
2. НАДН и НАДФН — коферменты реакций (НАДН-оксидазной и НАДФН-оксидазной), способствующих возникновению активных форм кислорода в фагоцитах.
B2 Кофермент ФМН и ФАД
1. ФМН и ФАД — коферменты оксидаз, переносящих электроны с окисляемого субстрата на кислород. Это ферменты распада аминокислот (оксидазы D- и L-аминокислот), нуклеотидов (ксантиноксидаза), биогенных аминов (моно- и диа-минооксидазы).
2. ФАД — кофермент пируват- и альфа-кетоглутаратдегидрогеназных комплексов. Совместно с тиаминпирофосфатом и другими коферментами катализируют окислительное декарбоксилирование кетокислот.
Date: 2016-05-24; view: 2454; Нарушение авторских прав
Источник
Кофакторы ферментов: ионы металлов и коферменты.
Активность ряда ферментов (простые белки) в норме зависит только от их структуры, тогда как для других, названных холоферментами (сложные белки), требуются кофакторы — вещества небелковой природы, в роли которых могут быть сложные органические соединения (коферменты) и ионы металлов.
Кофактор может образовывать с апоферментом прочные ковалентные связи. В этом случае кофермент называют простетической группой фермента. Примерами могут служить ФАД, ФМН, биотин, ковалентно связанный с остатком лизина в активном центре, Zn2+, который содержится в активном центре карбоксипептидазы. В том случае, если кофермент связывается с апоферментом нековалентными связями только на время химической реакции (НАД+ и НАДФ+), он может рассматриваться в качестве второго субстрата данного фермента Один и тот же кофермент может участвовать в разных биохимических реакциях, комплементарно связываясь с разными апоферментами. Собственной каталитической активностью коферменты не обладают.
Апофермент формирует активный центр, отвечает за специфичность действия фермента, фиксирует и ориентирует субстрат в активном центре и создает условия для преобразования субстрата в продукты реакции. Ионы металла выполняют две главные функции.
I). Стабилизируют нативную конформацию фермента, структуру его активного центра и субстрата. 2). Участвуют в ферментативном катализе.
1). Металлоферменты, лишенные ионов металла, либо сохраняют способность к химическому катализу, утрачивая стабильность, либо полностью теряют активность. Например, щелочная фосфатаза — металлофермент, в активном центре которого находится Zn2+, лишенная ионов цинка щелочная фосфатаза, теряет ферментативную активность, но восстанавливает ее после добавления металла. В некоторых металлоферментах ион металла (Mg2+, Mn2+, Zn2+, Co2+, Мо2+) участвует в образовании связи между молекулой субстрата и активным центром кофермента. в отсутствие иона эти ферменты не обладают активностью. Ряд ферментов в качестве субстрата используют комплекс превращаемого вещества с ионом. Для большинства киназ одним из субстратов служит не молекула АТФ, а комплекс Mg2+-ATФ.
2). Ферментативный электрофильный катализ. Ионы металла непосредственно участвуют в катализе и локализованы в активном центре фермента.В активном центре ферментов могут содержатся Zn 2+, Mn 2+, Fe 2+, Си 2+. Пример элек-трофильного катализа — действие карбоангидразы, содержащей ион цинка в активном центре.
B6 Коферментные функции выполняют два фосфорилированных производных пиридоксина: пиридоксальфосфат и пиридоксаминофосфат. Распад коферментов идет путем дефосфорилирования и окисления с образованием 4-пиридоксиловой кислоты. которая выводится из организма.
Коферментные формы витамина В6 включены в реакции, катализируемые почти всеми классами ферментов. Наиболее значительная группа пиридоксалевых ферментов — аминотрансферазы. Пиридоксальзависимые (пиридоксалевые ферменты) ферменты катализируют взаимопревращения и распад аминокислот (регулируют аминокислотный состав крови при разном аминокислотном составе пиши), участвуют в специфических реакциях метаболизма отдельных аминокислот (серина, треонина, триптофана). Участвуют в обмене липидов, синтезе сфинголипидов. В качестве кофактора ферментов участвуют в начальных стадиях синтеза гема. Влияют на обмен жирных кислот.
PP — предшественник коферментов -никотинамидадениндинуклеотида (НАД+) и никотинамидадениндинуклеотид-фосфата (НАДФ ), входящих в состав дегидрогеназ и редуктаз.
НАД+ и НАДФ+ приобретают коферментные функции после присоединения к никотинамиду радикала, включающего остаток рибозы, пирофосфат и нуклеотид — аденин. Витамин РР такими функциями не обладает.
1. НАД+ — кофермент дегидрогеназ, участвующих в реакциях окисления глюкозы, жирных кислот, глицерола, аминокислот после их дезаминирования; является коферментом дегидрогеназ цикла Кребса (кроме сукцинатдегидрогеназы). В этих реакциях кофермент выполняет функцию промежуточного акцептора электронов и протонов.
2. НАДН и НАДФН — коферменты реакций (НАДН-оксидазной и НАДФН-оксидазной), способствующих возникновению активных форм кислорода в фагоцитах.
B2 Кофермент ФМН и ФАД
1. ФМН и ФАД — коферменты оксидаз, переносящих электроны с окисляемого субстрата на кислород. Это ферменты распада аминокислот (оксидазы D- и L-аминокислот), нуклеотидов (ксантиноксидаза), биогенных аминов (моно- и диа-минооксидазы).
2. ФАД — кофермент пируват- и альфа-кетоглутаратдегидрогеназных комплексов. Совместно с тиаминпирофосфатом и другими коферментами катализируют окислительное декарбоксилирование кетокислот.
Дата добавления: 2018-10-15; просмотров: 301 | Нарушение авторских прав | Изречения для студентов
Читайте также:
Рекомендуемый контект:
Поиск на сайте:
© 2015-2020 lektsii.org — Контакты — Последнее добавление
Источник
Большинство
ферментов для проявления ферментативной
активности нуждается в низкомолекулярных
органических соединениях небелковой
природы (коферментах) и/или в ионах
металлов (кофакторах).
Термин.
«кофермент» был введён в начале XX
века и обозначал часть некоторых
ферментов, которая легко отделялась от
белковой молекулы фермента и удалялась
через полупроницаемую мембрану при
диализе. Несколько позже было выяснено,
что большинство ферментов состоит из
термолабильной белковой части и
термостабильного небелкового фактора
— кофермента. Белковая часть получила
название «апофермент», который в
отсутствие кофермента не обладает
каталитической активностью. Кофермент
с белковой молекулой (апоферментом)
формируют молекулу холофермента,
обладающую каталитической активностью.
А.
Кофакторы
Более
25% всех ферментов для проявления полной
каталитической активности нуждается
в ионах металлов. Рассмотрим роль
кофакторов в ферментативном катализе.
Роль
металлов в ферментативном катализе
Не
менее важную роль отводят ионам металлов
в осуществлении ферментативного
катализа.
Участие
в электрофильном катализе
Наиболее
часто эту функцию выполняют ионы металлов
с переменной валентностью, имеющие
свободную d-орбиталь и выступающие в
качестве электрофилов. Это, в первую
очередь, такие металлы, как Zn2+,
Fe2+,
Mn2+,
Cu2+.
Ионы щёлочно-земельных металлов, такие
как Na+ и К+,
не обладают этим свойством. В качестве
примера можно рассмотреть функционирование
фермента карбоангидразы. Карбоангидраза
— цинксодержащий фермент, катализирующий
реакцию образования угольной кислоты:
СО
+ H2O
↔ H2CO3.
Ион
Zn2+ в
результате электрофильной атаки
участвует в образовании Н+ и
ОН- ионов
из молекулы воды:
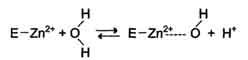
Протон
и гидроксйльная группа последовательно
присоединяются к диоксиду углерода с
образованием угольной кислоты.
В
ходе электрофильного катализа ионы
металлов часто участвуют в стабилизации
промежуточных соединений.
Участие
в окислительно-восстановительных
реакциях
Ионы
металлов с переменной валентностью
могут также участвовать в переносе
электронов. Например, в цитохромах
(гемсодержащих белках) ион железа
способен присоединять и отдавать один
электрон:
![]()
Благодаря
этому свойству цитохромы участвуют в
окислительно-восстановительных реакциях.
Другой
пример участия ионов металлов в
окислительно-восстановительных реакциях
— работа фермента дофамингидроксилазы,
катализирующего реакцию образования
норадреналина при участии витамина С
За
окислительно-восстановительные свойства
у дофамингидроксилазы отвечает ион
меди
Фермент,
содержащий ион Сu2+,
не вступает в реакцию с молекулой
кислорода. При восстановлении Си2+ до
Си+ с
помощью аскорбиновой кислоты образуется
ион меди, способный взаимодействовать
с кислородом с образованием перекисного
соединения. Далее гидроксильная группа
переносится на молекулу дофамина с
образованием норадреналина.
Коферменты
Как
уже было сказано, для проявления
каталитической активности большинству
ферментов необходимо наличие кофермента.
Исключение составляют гидролитические
ферменты (например, протеазы, липазы,
рибонуклеаза), выполняющие свою функцию
в отсутствие кофермента.
Кофермент,
локализуясь в каталитическом участке
активного центра, принимает непосредственное
участие в химической реакции, выступая
в качестве акцептора и донора химических
группировок, атомов, электронов. Кофермент
может быть связан с белковой частью
молекулы ковалентными и нековалентными
связями. В первом случае он называется
простетической группой (например, FAD,
FMN, биотин, липоевая кислота). Вместе с
тем известны примеры, когда кофермент
присоединяется к ферменту нековалентными
связями настолько прочно, что не
диссоциирует от белковой молекулы,
например тиаминдифосфат.
Во
втором случае кофермент взаимодействует
с ферментом только на время химической
реакции и может рассматриваться в
качестве второго субстрата. Примеры —
NAD+,
NADP+.
Апофермент
обеспечивает специфичность действия
и отвечает за выбор типа химического
превращения субстрата. Один и тот же
кофермент, взаимодействуя с различными
апоферментами, может участвовать в
разных химических превращениях субстрата.
Например, пиридоксальфосфат в зависимости
от того, с каким апоферментом
взаимодействует, участвует в реакциях
трансаминирования или декарбоксилирования
аминокислот.
Химическая
природа коферментов, их функции в
ферментативных реакциях чрезвычайно
разнообразны. Традиционно к коферментам
относят производные витаминов, хотя
помимо них есть значительный класс
небелковых соединений, принимающих
участие в проявлении каталитической
функции ферментов.
К
коферментам относят следующие соединения:
-производные
витаминов;
-гемы,
входящие в состав цитохромов, каталазы,
пероксидазы, гуанилатциклазы, NO-синтазы
и являющиеся простетической группой
ферментов;
-нуклеотиды
— доноры и акцепторы остатка фосфорной
кислоты;
-убихинон,
или кофермент Q, участвующий в переносе
электронов и протонов в ЦПЭ;
-фосфоаденозилфосфосульфат,
участвующий в переносе сульфата;
-S-аденозилметионин
(SAM) — донор метильной группы;
-глутатион,
участвующий в окислительно-восстановительных
реакциях.
Строение
и функции этих коферментов подробно
рассмотрены в соответствующих разделах
учебника.
Водораствор
витамины являются энзимовитаминами,
то есть выполняют коферментные функции
в составе ферментов. Проявления и
механизмы гиповитаминозов по различным
энзимовитаминам взаимосвязаны и
перекрываются, хотя для большинства из
них описаны и специфические
авитаминозы.
Витамин
В2, рибофлавин. входит в состав двух
коферментов ФМН и ФАД, являющихся
компонентами таких ферментов как
сукцинатдегидрогеназа, дегидрогеназы
жирных кислот, оксидаз аминокислот,
МАО, цитохромредуктазы.Витамин В5, РР
входит в состав коферментов НАД и
НАДФ,которые являются коферментами
более ста дегидрогеназ, участвующих в
тканевом дыхании, окислении молочной,
яблочной, кетоглутаровой, изолимонной
кислот, фосфоглицеринового альдегида,
жирных кислот и т.п.Витамин В6, пиридоксин
Этот витамин в виде коферментов ПАЛФ
(пиридоксальфосфата) и ПАМФ(пиридоксаминфосфата)
входит в состав ферментов переаминирования,
дезаминирования и декарбоксилирования
аминокислот. В реакциях с участием
пиридоксина, осуществляется всасывание
и транспорт аминокислот, балансируется
аминокислотный состав организма.Витамин
Н, биотин служит коферментом карбоксилаз,
таких как пируваткарбоксилаза,
ацетил-КоА-карбоксилаза,
пропионил-КоА-карбоксилаза. Биотин
связывает молекулу углекислого газа и
включает его в органическое вещество.
Как кофермент витамин Н участвует т в
синтезе жирных кислот, стеринов, пуриновых
оснований, мочевины, превращении
пиовиноградной кислоты в щавелевоуксусную
кислоту.Витамин В3, пантотеновая кислота
входит в состав кофермента ацетилирования
(КоА), который активирует ацетат и
ацильные группы, необходимые для синтеза
жирных кислот, стеролов, ацетилхолина.
Пантотеновая кислота участвует в
биосинтезе жирных кислот
Соседние файлы в папке Всякое
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Витамин В12 из пищи связывается с гликопротеином, синтезируемым обкладочными клетками слизистой оболочки желудка, называемым внутренним фактором касла. Депо – печень, селезенка, почки.
Бх функции:
1. Синтез метионина из гомоцистеина
Изомеризация Д-метилмалонил-КОа в сукцинил-КОа
Гиповитаминоз возникает при неполноценном питании и вегетарианской диете. Гиповитаминоз проявляется злокачественной мегалобластической анемией (аддисона – бирмера) нарушение кроветворной функции и поражение спинного мозга.
Источники : синтезируется исключительно микроорганизмами. При наличии никотиновой кислоты (РР)
Потребность : 2-5 мкг в сут
16. Особенности строения НАДФ и его роль в метаболизме.
НАДФ и НАД:Никотинамидадениндинуклеотидфосфат (НАДФ)- участв в реакциях окисл — восстановл. Структура НАДФ служит акцептором водорода при окисл углеводов; в восстановленной форме явл донором водорода при биосинтезе жирных к-т. В хлоропластах растит кл НАДФ восстанавл-ся при световых реакциях фотосинтеза.
Во многих окисл-восстанов реакциях НАДФ присоедин протон и 2 электрона, переносимые от окисляемого субстрата к окисленному коферменту; в обратной реакции водород переносится от восстановл кофермента к субстрату. При этом водород отщепл-ся и присоед-ся к атому углерода амида никотиновой кислоты в 4-м положении:
1. НАдфН – донор водорода в реакциях синтеза жирных кислот, холестерина, стероидных гормонов и некоторых других соединений.
2. Надфн – компонент монооксигеназной цепи микросомального окисления, выполняющий функцию детоксикации антибиотиков и других чужеродных веществ
3. Надф+ — аллостерический регулятор ферментов энергетического обмена, в частности, ферментов цикла Кребса, а также реакций синтеза глюкозы (глюконеогенез)
17. Строение ФАД и его роль в клеточном метаболизме.
Восстановл формы этих Во флавиновых коферментах (ФАД-флавинмононуклеотид или ФМН-флавинаденинуклеотид), активной частью мол кот явл изоаллоксазиновое кольцо, в результате восстановления чаще всего наблюд присоедин 2 протонов и 2 электронов одновременно:
кофакторов способны транспортировать водород и электроны к дых цепи митох или иных энерго-сопрягающих мембран.
Биологическое значение Фад определяется тем, что он является простетической группой флавиновых ферментов. Выполняют функции переносчиков водорода, регулируя окислительные и восстановительные процессы в тканях, необходимые для энергетического метаболизма и клеточного дыхания. Участвует в обмене белков, углеводов, жиров и синтезе гемоглобина.
1. кофермент оксидаз
2. промежуточный переносчик электронов и протонов в дыхательной цепи
3. кофермент пируват – и альфа-кетоглутаратдегидрогеназных комплексов
4. катализирует реакции окисления жирных кислот в митохондриях
18. Фосфопиридоксаль и его роль в клеточном метаболизме. Представление о реакциях трансаминирования.
Пиридоксальфосфат — производное пиридоксина (витамина В6)
Витамин В6 (пиридоксин, антидерматитный)- самост независ пищевой фактор.Термином вит В6, обознач все три производных 3-оксипиридина, облад-х одинаковой вит активностью: пиридоксин (пиридоксол), пиридоксаль и пиридоксамин:
Структурной особенностью пиридоксальфосфата является наличие формильной группы – необходимой для формирования ковалентной связи с аминокислотой и фосфатной группы, благодаря которой коэнзим удерживается в активном центре фермента.
Ковалентное присоединение аминокислоты к пиридоксальфосфату в активном центре фермента и переток электронов к азоту пиридонового кольца ведут к образованию квазистабильной структуры. При этом ослабляются связи альфа-углеродного атома аминокислоты с:
-карбоксильной группой (декарбоксилазы)
-атомом водорода (трансаминазы)
— радикалом аминокислоты (альдолазы)
Трансаминирование – процесс переноса аминогруппы от аминокислоты на альфа-кетокислоту с помощью ферментов аминотрансфераз с образованием новых заменимых аминокислот и альфакетокислот
21, 22 Пантотеновая кислота, ее строение и роль в метаболизме.
Пантотеновая кислота (вит В3)- явл комплексным соединением β-аланина и 2,4-диокси-3,3-диметил масляной к-ты.
Пантотеновая к-та представляет собой вязкую светло-желтую жидкость, хорошо раствор в воде; она малоустойчива и легко гидролизуется поместу пептидной связи под действием слабых кислот и щелочей.
Пантонетновая кислота, синтезируемая растениями и микроорганизмами (и в кишечнике), в организме человека превращается в коэнзим А (КоА) и 4-фосфопантотеин. После поступления концентрируется в печени, сердце, почках и др тканях.
Биологическая роль.В виде коэнзима А находится во всех живых клетках (пантотеновая – вездесущая). В составе коферментов участвует в ключевых процессах метаболизма : переносе ацильных групп в реакциях общего пути катаболизма, активации жирных кислот, их окислении и синтезе, синтезе холестерина и кетоновых тел, в образовании и расщеплении лимонной кислоты.
1. Активирование ацетата
2. Активирование жирных кислот
3. Транспортирует короткоцепочечные жирные кислоты в митохондрии.
4. Участвует в окислительном декарбоксилировании кетокислот.
Источники –в растительных животных и микробиологических объектах, много в яичном желтке, цветочной пыльце, хлебе, печени.
Потребность : 5-15 мг в сут.
Гиповитаминоз : заболевание жкт, судороги, невриты, дерматиты.
23, 24 Фолиевая кислота, ее строение и биологическая роль.
Фолиевая к-та (фолацин) –Витамин В9
Фолиевая к-та сост из 3 структурных единиц: птеридина, эн-аминобензойной и глутаминовой кислот и имеет след структуру:
В организме человека она превращается в кофермент ТГФК путем его восстановления. В крови основное количество витамина входит в состав эритроцитов. Он депонируется в печени, почках, слизистой оболочке кишечника.
Тгфк участвует в переносе одноуглеродных фрагментов с промежуточной степенью окисления в процессе биосинтеза пуринов, метионина, участвует во взаимопревращениях серина и глицина.
ТГФК мобилизует и переносит одноуглеродные функциональные группы: метенильную, метиленовую, метенильную, формильную и формиминогруппу.
Бх функции:
1. Синтез пуриновых нуклеотидов
2. метаболизм аминокислот
Источники: листья растений, бобы, печень, дрожжи. Синтезируется микрофлорой кишечника
Потребность: 180-200 мкг в сут.
Гиповит: нарушение кроветворения
26. Кофакторы ферментов: ионы металлов и коферменты. Коферментные функции витаминов (на примере трансаминаз и дегидрогеназ, витаминов В6, РР, B2).
.Активность ряда ферментов (прост б) в N завис только от их структуры, тогда как для др, названных холоферментами (сложн б), требуются кофакторы – ве-ва небелк природы, в роли кот м б сложн органич соедин-я (коферменты) и ионы металлов.
Кофактор м образовывать с апоферментом прочн ковалентные связи. В этом случае кофермент наз простетической гр фермента. Примерами могут служить ФАД, ФМН, биотин. Коферментные формы вит В6 включ в реакции, катализируемые почти всеми кл ферментов. Наиб значительная гр пиридоксалевых ферментов – аминотрансферазы.
PP — предшественник коферментов -никотинамидадениндинуклеотида (НАД+) и никотинамидадениндинуклеотид-фосфата (НАДФ ), вход в сост дегидрогеназ и редуктаз. НАД+ и НАДФ+ приобр коферментные фу-ии после присоедин к никотинамиду радикала, включ остаток рибозы, пирофосфат и нуклеотид — аденин. Вит РР такими фу-ми не обладает.
B2Кофермент ФМН и ФАД
1. ФМН и ФАД — коферменты оксидаз,перенос электроны с окисляемого субстрата на О2. Это ферменты распада аминок-т (оксидазы D- и L-аминокислот), нуклеотидов (ксантиноксидаза),биогенных аминов (моно- и диа-минооксидазы).
2. ФАД — кофермент пируват- и альфа-кетоглутаратдегидрогеназных комплексов
29. Витамины В2 и РР их химическое строение и роль в клеточном метаболизме.
Витамин РР(Никотиновая к-та) -соединение пиридинового ряда, содерж карбоксильную гр (никотинамид отлич наличием амидной гр).
РР малорастворим в воде (примерно 1%), но хор растворим в водных р-рах щелочей. Вит кристаллизуется в виде белых игл. Наиб характерными признаками авитаминоза РР, т.е. пеллагры явл поражения кожи (дерматиты), пищеварит тракта (диарея) и нар нервн деятельности (деменция). Биологическая роль-РР
вход в состав НАД или НАДФ, явл коферментами многих обратимо действ в окисл-восстановит. реакциях дегидрогеназ. 44)НАДФ и НАД:Никотинамидадениндинуклеотидфосфат (НАДФ)- участв в реакциях окисл — восстановл. Структура НАДФ служит акцептором водорода при окисл углеводов; в восстановленной форме явл донором водорода при биосинтезе жирных к-т. В хлоропластах растит кл НАДФ восстанавл-ся при световых реакциях фотосинтеза. НАД (никотинамидадениндинуклеотид)- кофермент, присутств во всех живых кл; входит в состав ферментов гр дегидрогеназ, катализирующих окисл-восстановительные реакции.
Во многих окисл-восстанов реакциях НАД или НАДФ присоедин протон и 2 электрона, переносимые от окисляемого субстрата к окисленному коферменту; в обратной реакции водород переносится от восстановл кофермента к субстрату. При этом водород отщепл-ся и присоед-ся к атому углерода амида никотиновой кислоты в 4-м положении:
В основе лежит гетероциклич соединение изоаллоксазин (сочет бензольного, пиразинового и пиримидинового колец), к кот в полож 9 присоединен пятиатомный спирт риби-тол. Рибофлавин хор раствор в воде, устойчив в кислых р-рах,но легко разруш-ся в нейтр и щелочных р-рах. Он весьма чувствителен к видимому и УФ-излучению и сравнит легко подвергается обратимому восстан-ию, присоединяя водород по месту двойных связей и превращаясь в бесцветную лейкоформу. Это свойство рибофлавина легко окисляться и восстанавливаться лежит в основе его биологического действия в клеточном метаболизме. Клинич проявл недостаточности рибофлавина на эксперимент животных.Помимо остановки роста, выпадения волос(алопеция), характерных воспалит проц слизистой оболочки языка (глоссит), губ, особенно у углов рта, эпителия кожи. Биологич роль-Рибофлавин входит в состав флавиновых коферментов, в частности ФМН и ФАД , являющ в свою очередь простетическими гр ферментов ряда других сложн б – флавопротеинов.
Во флавиновых коферментах (ФАД-флавинмононуклеотид или ФМН-флавинаденинуклеотид), активной частью мол кот явл изоаллоксазиновое кольцо, в результате восстановления чаще всего наблюд присоедин 2 протонов и 2 электронов одновременно:
Восстановл формы этих кофакторов способны транспортировать водород и электроны к дых цепи митох или иных энерго-сопрягающих мембран.
Источник
